中國(guó)科學(xué)院蘇州生物醫(yī)學(xué)工程技術(shù)研究所展示的雙光子顯微鏡。
武漢友芝生物制藥有限公司科研人員在進(jìn)行實(shí)驗(yàn)。
本報(bào)記者 杜 芳攝
“腫瘤高發(fā),為什麼沒(méi)有我們自己的藥物?”“外國(guó)藥太貴了,可便宜的國(guó)産藥能達(dá)到治療效果嗎?”“這些藥安全嗎?”這些醫(yī)生們常常聽(tīng)到的問(wèn)題,最能反映百姓心中存在已久的顧慮,創(chuàng)新、有效、安全成為擺在中國(guó)醫(yī)藥研製面前的三道考題。
如今,隨著重大新藥創(chuàng)制國(guó)家科技重大專(zhuān)項(xiàng)的實(shí)施推進(jìn),新藥創(chuàng)制格局發(fā)生改變,一批藥物創(chuàng)制關(guān)鍵技術(shù)和生産工藝得以突破,我國(guó)自主研發(fā)的創(chuàng)新藥物登臺(tái)亮相,不但在一些領(lǐng)域打破了國(guó)外專(zhuān)利藥物壟斷,而且藥品安全性、可靠性提升。醫(yī)藥研發(fā)正由仿製逐漸走向創(chuàng)制,我國(guó)正從一個(gè)醫(yī)藥大國(guó)向醫(yī)藥強(qiáng)國(guó)邁進(jìn)。
新藥研發(fā)能力大幅提升
一批藥物創(chuàng)制核心關(guān)鍵技術(shù)取得突破,藥品品質(zhì)明顯提升,我國(guó)新藥創(chuàng)新能力得到國(guó)際認(rèn)可
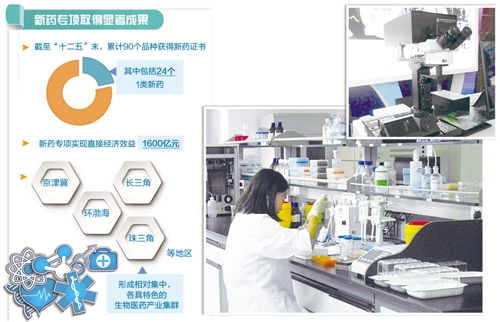
重大新藥創(chuàng)制國(guó)家科技重大專(zhuān)項(xiàng)實(shí)施8年來(lái),碩果纍纍。新藥專(zhuān)項(xiàng)實(shí)施管理辦公室主任、國(guó)家衛(wèi)生計(jì)生委科教司司長(zhǎng)秦懷金告訴《經(jīng)濟(jì)日?qǐng)?bào)》記者,截至“十二五”末,累計(jì)90個(gè)品種獲得新藥證書(shū),其中包括手足口病EV71型疫苗、Sabin株脊灰滅活疫苗、西達(dá)本胺、阿帕替尼等24個(gè)1類(lèi)新藥,是專(zhuān)項(xiàng)實(shí)施前總和的5倍。
與此同時(shí),一批核心關(guān)鍵技術(shù)取得了突破。秦懷金介紹,我國(guó)突破了抗體和蛋白藥物製備、生物大分子藥物給藥、藥物緩控釋製劑、中成藥二次開(kāi)發(fā)等一批瓶頸性關(guān)鍵技術(shù),臨床前評(píng)價(jià)、疫苗研發(fā)等技術(shù)逐步實(shí)現(xiàn)“跟跑”向“並跑”的轉(zhuǎn)變。
新藥的不斷推出,讓中國(guó)的老百姓實(shí)實(shí)在在受益。我國(guó)在肺癌、白血病、耐藥菌防治等領(lǐng)域打破國(guó)外專(zhuān)利藥物壟斷後,面對(duì)昂貴的外國(guó)藥便有了議價(jià)權(quán)。“國(guó)産小分子靶向抗癌藥鹽酸埃克替尼上市促使國(guó)外專(zhuān)利藥物降價(jià)超過(guò)50%,大幅減輕患者用藥負(fù)擔(dān)。”秦懷金説,不僅如此,我國(guó)技術(shù)改造200余種臨床急需品種,涉及15.3%的國(guó)家基本藥物,藥品品質(zhì)明顯提升,滿(mǎn)足了國(guó)內(nèi)百姓的需求。
自從我國(guó)科學(xué)家屠呦呦獲得諾貝爾獎(jiǎng),青蒿素的名字走進(jìn)了大眾視野,這種神奇的中藥對(duì)於瘧疾有明顯療效。而現(xiàn)在,中國(guó)科學(xué)家又提取出青蒿素的延伸物青蒿琥酯,它具有更強(qiáng)的作用和更長(zhǎng)久的療效。青蒿琥酯通過(guò)世界衛(wèi)生組織認(rèn)證,在國(guó)外使用,累計(jì)救治1500萬(wàn)瘧疾患者。中國(guó)新藥不僅填補(bǔ)國(guó)內(nèi)空白,也走向世界,為人類(lèi)健康作出了突出貢獻(xiàn)。
中國(guó)藥,再也不是“低端藥”的代名詞。我國(guó)新藥研發(fā)創(chuàng)新能力得到國(guó)際認(rèn)可,拉莫三嗪獲得美國(guó)FDA批準(zhǔn)上市,利培酮微球注射劑獲得美國(guó)FDA批準(zhǔn),直接提交新藥申請(qǐng),地奧心血康、丹參膠囊等獲得歐盟上市許可。帕拉米韋、磷酸奧司他韋、埃博拉病毒治療性抗體MIL77、重組埃博拉病毒疫苗等應(yīng)急藥品,為應(yīng)對(duì)全球應(yīng)急事件——傳染病的流行提供重要的生物安全保障。
技術(shù)創(chuàng)新能力不斷提升也使得我國(guó)醫(yī)藥産業(yè)快速發(fā)展。據(jù)初步統(tǒng)計(jì),新藥專(zhuān)項(xiàng)實(shí)現(xiàn)直接經(jīng)濟(jì)效益1600億元,推動(dòng)企業(yè)創(chuàng)新主體地位持續(xù)增強(qiáng),2015年規(guī)模以上企業(yè)研發(fā)投入約450億元;促進(jìn)京津冀、環(huán)渤海、長(zhǎng)三角、珠三角等地區(qū)形成相對(duì)集中、各具特色的生物醫(yī)藥産業(yè)集群,加快了區(qū)域經(jīng)濟(jì)發(fā)展和産業(yè)轉(zhuǎn)型升級(jí)。
安全評(píng)價(jià)與國(guó)際接軌
我國(guó)藥物非臨床安全性評(píng)價(jià)平臺(tái)法規(guī)依從性進(jìn)一步提高,國(guó)內(nèi)新藥加快進(jìn)入國(guó)際主流市場(chǎng)的步伐
“新藥研發(fā)涉及各個(gè)學(xué)科,環(huán)節(jié)多、週期長(zhǎng)、創(chuàng)新活動(dòng)複雜,從靶標(biāo)確定到産品開(kāi)發(fā)上市的全鏈條研發(fā)過(guò)程中,藥物非臨床安全評(píng)價(jià)(GLP)是新藥研發(fā)必要階段中極其重要的一環(huán)。”新藥專(zhuān)項(xiàng)技術(shù)總師、中國(guó)工程院院士桑國(guó)衛(wèi)説。
在新藥專(zhuān)項(xiàng)支援下,我國(guó)藥物非臨床安全性評(píng)價(jià)平臺(tái)(GLP)建設(shè)取得了一系列重大突破,GLP平臺(tái)的法規(guī)依從性進(jìn)一步提高,平臺(tái)管理水準(zhǔn)獲得國(guó)際認(rèn)可,新藥臨床前安全評(píng)價(jià)工作已與國(guó)際接軌。
桑國(guó)衛(wèi)介紹,我國(guó)已有11個(gè)平臺(tái)通過(guò)了國(guó)際實(shí)驗(yàn)動(dòng)物評(píng)估和認(rèn)可委員會(huì)(AAALAC)認(rèn)證,4個(gè)平臺(tái)接受並通過(guò)了美國(guó)FDA的GLP檢查,5個(gè)平臺(tái)通過(guò)了經(jīng)濟(jì)合作與發(fā)展組織(OECD)成員國(guó)正式GLP檢查,3個(gè)平臺(tái)通過(guò)美國(guó)病理學(xué)家協(xié)會(huì)(CAP)認(rèn)證,9個(gè)平臺(tái)按照國(guó)際標(biāo)準(zhǔn)建立了實(shí)驗(yàn)室數(shù)據(jù)採(cǎi)集與管理的IS/IT系統(tǒng)、Provantis GLP Tox軟體和LIMS系統(tǒng)。
這些平臺(tái)瞄準(zhǔn)國(guó)際新技術(shù)方法發(fā)展前沿,進(jìn)一步完善藥物非臨床安全性評(píng)價(jià)技術(shù)體系,核心關(guān)鍵技術(shù)達(dá)到國(guó)際先進(jìn)水準(zhǔn)。桑國(guó)衛(wèi)説,GLP平臺(tái)為國(guó)內(nèi)外藥物研發(fā)企業(yè)提供規(guī)範(fàn)的技術(shù)服務(wù),累計(jì)開(kāi)展3500余個(gè)藥物的非臨床安全性評(píng)價(jià)研究,為我國(guó)具有自主智慧財(cái)産權(quán)的創(chuàng)新藥物研發(fā)提供了重要保障。此外,8個(gè)GLP平臺(tái)幫助我國(guó)醫(yī)藥企業(yè)提交境外新藥臨床研究申請(qǐng)300余個(gè),推動(dòng)一批國(guó)內(nèi)研發(fā)的藥品在美國(guó)、歐盟等地開(kāi)展臨床試驗(yàn),大大加快了國(guó)內(nèi)新藥進(jìn)入國(guó)際主流市場(chǎng)的步伐。
同時(shí),在新藥專(zhuān)項(xiàng)的帶動(dòng)下,我國(guó)已有63家GLP實(shí)驗(yàn)室通過(guò)了國(guó)家食品藥品監(jiān)督管理局認(rèn)證,這些蓬勃發(fā)展的GLP實(shí)驗(yàn)室在我國(guó)新藥研發(fā)産業(yè)鏈中發(fā)揮著越來(lái)越重要的作用。部分GLP平臺(tái)除了開(kāi)展藥品的安全性評(píng)價(jià)研究外,還將GLP平臺(tái)技術(shù)拓展到了農(nóng)藥、動(dòng)物食品、獸藥和環(huán)境毒物等領(lǐng)域的安全性研究,帶動(dòng)和促進(jìn)了其他行業(yè)的規(guī)範(fàn)發(fā)展。
桑國(guó)衛(wèi)表示,“十三五”期間,新藥專(zhuān)項(xiàng)將繼續(xù)圍繞“出新藥”“保安全”的戰(zhàn)略需求,針對(duì)當(dāng)前國(guó)內(nèi)藥物毒理學(xué)研究的薄弱環(huán)節(jié),進(jìn)一步全面提升我國(guó)GLP平臺(tái)的創(chuàng)新能力和國(guó)際競(jìng)爭(zhēng)力,使其充分發(fā)揮對(duì)新藥研發(fā)創(chuàng)新鏈的“引領(lǐng)式”服務(wù)。
抓住一致性評(píng)價(jià)的關(guān)鍵
我國(guó)要更嚴(yán)格地做好一致性評(píng)價(jià)工作,確保仿製藥在品質(zhì)和療效上與原研藥保持一致
根據(jù)創(chuàng)新程度,藥品可分為兩個(gè)層級(jí):創(chuàng)新藥和仿製藥。我國(guó)是個(gè)仿製藥大國(guó),卻不是仿製藥強(qiáng)國(guó),低水準(zhǔn)仿製扎堆現(xiàn)象嚴(yán)重,部分仿製藥存在品質(zhì)不高、療效較弱等問(wèn)題。
安全用藥、滿(mǎn)足臨床需求是新藥專(zhuān)項(xiàng)的目標(biāo),我國(guó)要向創(chuàng)新藥物和仿製藥物多投入,尤其需要通過(guò)嚴(yán)格的一致性評(píng)價(jià)獲得高品質(zhì)的仿製藥。
2015年,一致性評(píng)價(jià)工作開(kāi)展,相關(guān)政策文件密集發(fā)佈。中國(guó)食品藥品檢定研究院院長(zhǎng)李波表示,“一致性評(píng)價(jià)工作是大家關(guān)注的熱點(diǎn),一致性評(píng)價(jià)的目的就是要使國(guó)內(nèi)上市的仿製藥在品質(zhì)和療效上與原研藥保持一致,在臨床上與原研藥可以相互替代,滿(mǎn)足公眾對(duì)高品質(zhì)仿製藥的需求;同時(shí)降低藥品費(fèi)用的總支出,淘汰落後産能,提高國(guó)産仿製藥在國(guó)際上的競(jìng)爭(zhēng)力”。
一致性評(píng)價(jià)“大考”開(kāi)啟,加快了我國(guó)醫(yī)藥産業(yè)優(yōu)勝劣汰、轉(zhuǎn)型升級(jí)的步伐。目前,已經(jīng)通過(guò)新版GLP認(rèn)證的國(guó)內(nèi)5000多家制藥企業(yè),除了研發(fā)實(shí)力比較強(qiáng)的大企業(yè)以外,大部分企業(yè)都需要平臺(tái)支撐。
重大專(zhuān)項(xiàng)支撐的平臺(tái)優(yōu)勢(shì)得以充分發(fā)揮,其利用技術(shù)儲(chǔ)備對(duì)一致性評(píng)價(jià)工作進(jìn)行技術(shù)支撐,一方面為新藥和仿製藥一致性評(píng)價(jià)工作需要的關(guān)鍵技術(shù)、出現(xiàn)的問(wèn)題保駕護(hù)航,另一方面在國(guó)內(nèi)重大科研院所和專(zhuān)項(xiàng)支援的平臺(tái)以及企業(yè)間搭建橋梁,加快推進(jìn)一致性評(píng)價(jià)工作。
“此外,臨床前安全評(píng)價(jià)平臺(tái)不但承擔(dān)著國(guó)家創(chuàng)新藥物的安全性評(píng)價(jià)的重要職責(zé),同時(shí)也承擔(dān)著由於藥物引起的或者可能引起的毒性作用及其毒性機(jī)制進(jìn)行深入研究的重要職責(zé)。”中科院上海藥物研究所藥物安全評(píng)價(jià)研究中心主任任進(jìn)説。
今年,牽動(dòng)千家藥企神經(jīng)的仿製藥一致性評(píng)價(jià)將進(jìn)入全面監(jiān)督評(píng)價(jià)階段。石藥、華潤(rùn)雙鶴、羅欣藥業(yè)等諸多藥企都紛紛表示,正在加速推進(jìn)仿製藥品質(zhì)和療效一致性評(píng)價(jià)進(jìn)程。
“新藥專(zhuān)項(xiàng)也罷,生物醫(yī)藥産業(yè)也罷,正在經(jīng)歷以仿製為主到創(chuàng)倣結(jié)合的過(guò)程。”桑國(guó)衛(wèi)説,“創(chuàng)新藥的關(guān)鍵在於創(chuàng)新,包括新的靶點(diǎn)、新的結(jié)構(gòu)、新的作用機(jī)制,也包括疾病譜的改變所導(dǎo)致的藥物研究的創(chuàng)新。仿製藥研發(fā)的關(guān)鍵是,要嚴(yán)格做好一致性評(píng)價(jià)工作,任務(wù)雖然艱巨,但我們有信心”。(經(jīng)濟(jì)日?qǐng)?bào)·中國(guó)經(jīng)濟(jì)網(wǎng)記者 杜 芳)
[責(zé)任編輯:郭曉康]